Nauczyciel: Małgorzata Przywara
Chemia 7a_7b
05.05.2020 r. Temat: Sprawdzian wiadomości z działu: „Woda i roztwory wodne”.
Sprawdzenia wiadomości będzie w formie testu (quizu) , który odbędzie się we wtorek 5 maja 2020 r. O szczegółach poinformuję na klasowej grupie na Messenger.
Test będzie na platformie Qiuzizz. Należy zalogować się swoim imieniem i nazwiskiem. Następnie wpisać kod, który podam we wtorek na klasowej grupie i rozpocząć quiz.
07.05.2020 r. Temat: Tlenki metali i tlenki niemetali.
Otwórz podręcznik na stronie 196 i przeczytaj dzisiejszy temat. Następnie otwórz układ okresowy, który jest na końcu podręcznika (we wkładce), a następnie obejrzyj lekcję na stronie:
https://www.youtube.com/watch?v=AisZPD0G3sw
Na podstawie wiadomości z podręcznika i filmu zrób zadanie 1 i 2 str. 201
Jeśli masz trudności z tymi zadaniami to zajrzyj na stronę
https://www.youtube.com/watch?v=VzK5uW1zOpQ

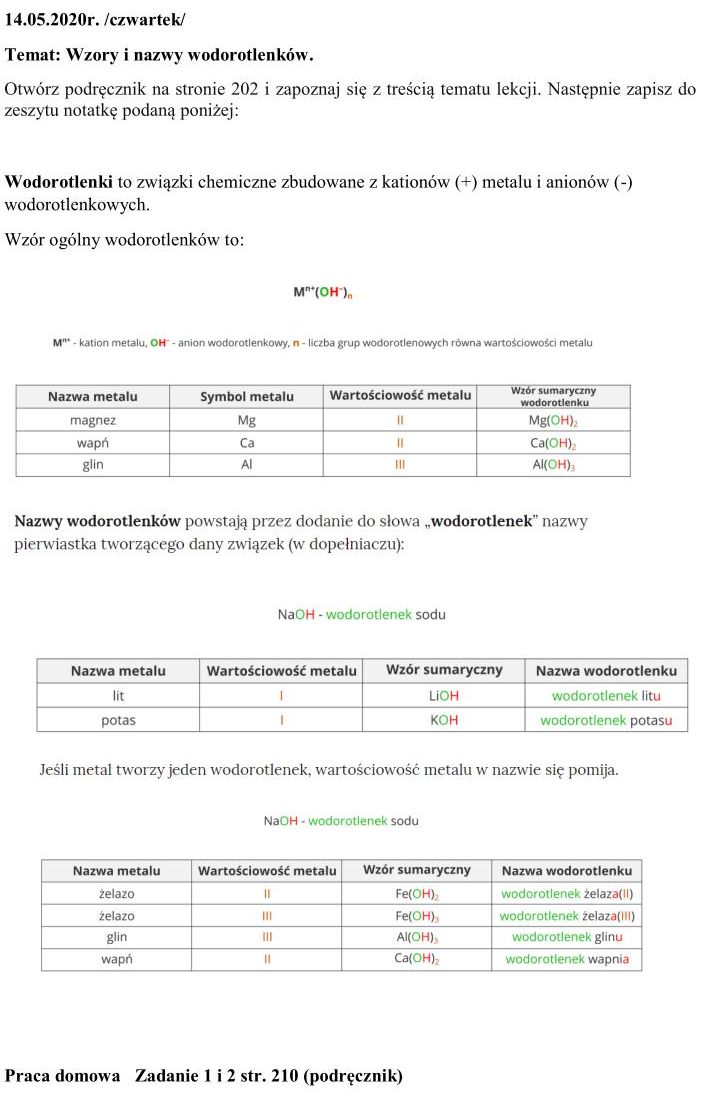
19.05.2020 r. /wtorek/
Temat: Wodorotlenek sodu i wodorotlenek potasu i właściwości i zastosowanie.
Na wstępie dzisiejszej lekcji przedstawiam poprawnie pokolorowaną tabelę ze wskaźnikami.
| Wskaźnik/odczyn | Kwasowy | obojętny | zasadowy |
| Uniwersalny papierek wskaźnikowy | CZERWONY | ŻÓŁTY | NIEBIESKO–ZIELONY |
| Fenoloftaleina | BEZBARWNY | BEZBARWNY | MALINOWY |
| Oranż metylowy | CZERWONY | ŻÓŁTY | ŻÓŁTY |
Zapraszam Was dzisiaj do zasobów epodrecznika
https://epodreczniki.pl/a/wodorotlenki—ich-budowa-iotrzymywanie/D1F3LscyE
lub podręcznika w formie „papierowej” na stronie 211.
Proszę o zapoznanie się z treściami dotyczącymi wodorotlenku sodu i potasu. Czytajcie tak, aby potem uzupełnić notatkę, która może mieć postać tabeli:
Wodorotlenek sodu Wodorotlenek potasu
Wzór sumaryczny
Masa cząsteczkowa
Właściwości fizyczne
Właściwości chemiczne
Sposób otrzymywania
Zastosowanie
Następnie skorzystajcie z podręcznika str. 211 oraz krótkiego filmu na https://www.youtube.com/watch?v=CoVAwxqnp1U
I uzupełnij schematy doświadczeń:

21.05.2020r. /czwartek/
Temat: Wodorotlenek wapnia.
Otwórz podręcznik na stronie 216 i zapoznaj się z treścią tematu lekcji. Następnie wykonaj opisy doświadczenia, na podstawie podręcznika (doświadczenie 34 str. 216)

26.05.2020r. /wtorek/
Temat: Sposoby otrzymywania wodorotlenków praktycznie nierozpuszczalnych w wodzie.
We wtorek 26 maja 2020r. o godz. 9:30 test na quizizz z wodorotlenków. Jest to kartkówka z 4 ostatnich lekcji.
Wejdź na www.quizizz.com Zaloguj się swoim imieniem i nazwiskiem i sprawdź swoją wiedzę. Potwierdzeniem Twojej aktywności na dzisiejszej lekcji, jest udział w quizie.
28.05.2020r. /czwartek/
Temat: Sposoby otrzymywania wodorotlenków praktycznie nierozpuszczalnych w wodzie.
Otwórz podręcznik na stronie 219 i zapoznaj się z tematem.
Zapisz do zeszytu podaną notatkę:
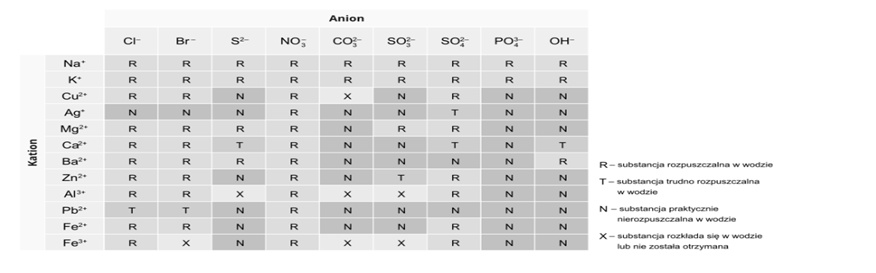
Kiedy zmieszamy ze sobą roztwory substancji, które występują w postaci jonów, to może się tak zdarzyć, że kation jednej substancji stworzy trudno rozpuszczalny związek z anionem drugiej substancji. Obserwujemy wówczas strącanie się osadu. Aby przewidzieć, czy po zmieszaniu dwóch roztworów substancji jonowych wytrąci się osad, można wykorzystać tablicę rozpuszczalności. Na jej podstawie możemy ocenić, czy obecne w powstałej mieszaninie jony utworzą trudno rozpuszczalny związek.
Na końcu podręcznika oraz poniżej, znajduje się tabela rozpuszczalności wodorotlenków i soli w wodzie. W jednej kolumnie są jony dodatnie (kationy), a w drugiej jony ujemne (aniony). Na „skrzyżowaniu” są oznaczenia, które wskazują, czy dany związek rozpuszcza się, czy nie rozpuszcza w wodzie.
Praca domowa
Skorzystaj z tabeli rozpuszczalności i wypisz wzory i nazwy:
- Wodorotlenków praktycznie nierozpuszczalnych w wodzie
- Wodorotlenków trudno rozpuszczalnych w wodzie
- Wodorotlenków rozpuszczalnych w wodzie
Chemia 8a_8b
05.05.2020 r. Temat: Właściwości fizyczne i chemiczne białek.
Otwórz podręcznik na str.198 i przeczytaj, jakie charakterystyczne właściwości posiadają wielkocząsteczkowe związki, jakimi są białka. W celu poszerzenia wiadomości zapoznaj się z właściwościami białek, doświadczeniami, które pokazują charakter chemiczny tych związków na stronie https://epodreczniki.pl/a/bialka—wlasciwosci/DUyoKVZnH
Zapisz w zeszycie notatkę podaną poniżej:
Białko pod wpływem soli kamiennej ulega koagulacji odwracalnej, to odwracalny proces przejścia zolu w żel, podczas którego struktura przestrzenna białka nie ulega naruszeniu i po dodaniu wody wytrącony osad białka rozpuszcza się. Proces ten nazywamy inaczej wysalaniem.
Peptyzacja to odwracalny proces przejścia żelu w zol.
Denaturacja (inaczej ścięcie) jest procesem nieodwracalnym, podczas którego struktura przestrzenna białka zostaje zniszczona. Czynnikami powodującymi denaturację białka są: wysoka temperatura, sole metali ciężkich, stężone kwasy i zasady oraz etanol.
Reakcje biuretowa i ksantoproteinowa to reakcje barwne pozwalające wykryć obecność białka.
reakcja biuretowa to reakcja wykorzystywana do wykrywania wiązań peptydowych w białkach; zachodzi pod wpływem wodorotlenku miedzi(II); w wyniku tej reakcji pojawia się fioletowe zabarwienie
reakcja ksantoproteinowa (ksantos z łac. Żółty)to reakcja wykorzystywana do wykrywania obecności niektórych białek; zachodzi pod wpływem kwasu azotowego(V); w wyniku tej reakcji pojawia się żółte zabarwienie
07.05.2020 r. Tłuszcze i białka jako substancje o znaczeniu biologicznym.
W celu sprawdzenia stopnia opanowania wiadomości o tłuszczach i białkach przeprowadzę test formie quizu , który odbędzie się w czwartek 7 maja 2020 r. O szczegółach poinformuję na klasowej grupie na Messenger.
Test będzie na platformie Qiuzizz. Należy zalogować się swoim imieniem i nazwiskiem. Następnie wpisać kod, który podam we wtorek na klasowej grupie i rozpocząć quiz.
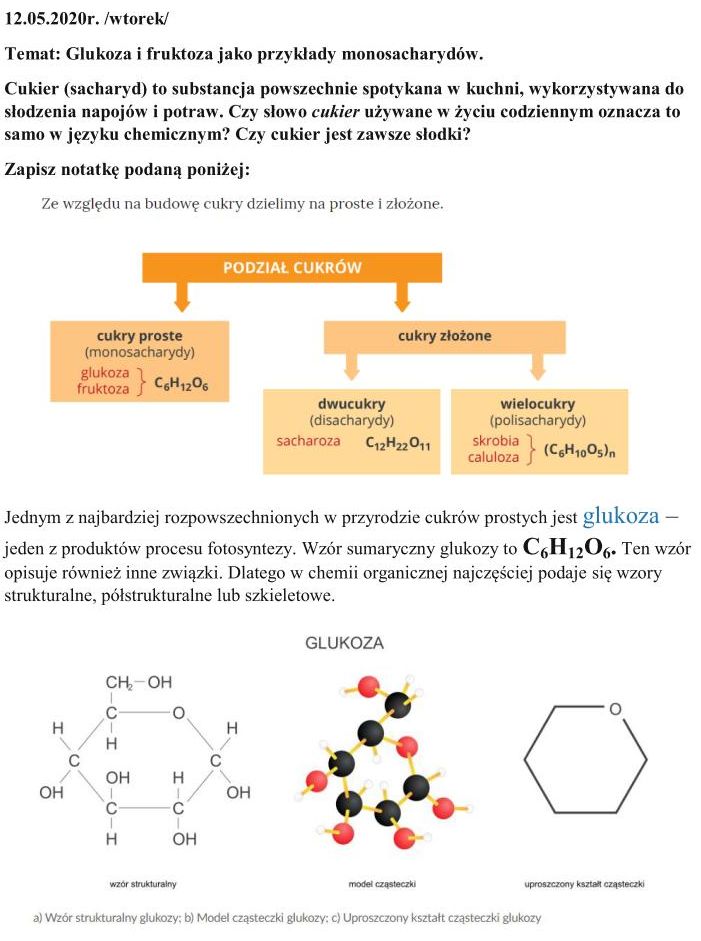


19.05.2020 r. /wtorek/
Temat: Skrobia i celuloza jako przykłady polisacharydów.
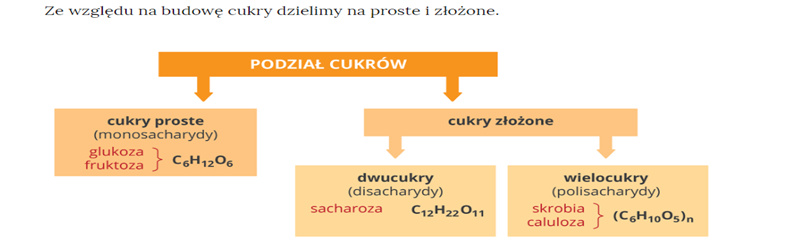
W celu poznania wiadomości na temat polisacharydów przypomnijmy podział cukrów poznany w ubiegłym tygodniu:
Jak widzicie, skrobia i celuloza są polisacharydami, czyli cukrami złożonymi z wielu cząsteczek cukrów prostych, czyli monosacharydów.
Zapisz do zeszytu podaną poniżej notatkę
Wzór ogólny polisacharydów to: (C6H10O5)n
n – oznacza liczbę grup, charakterystyczną dla danego związku
Skrobia jest związkiem wielkocząsteczkowym. Liczba cząsteczek glukozy, z których powstaje skrobia, waha się od kilkuset do kilku tysięcy i zależy od pochodzenia. Cukier ten jest bardzo ważnym składnikiem pożywienia człowieka. Występuje głównie w ziemniakach, ziarnach zbóż, nasionach, ryżu i kukurydzy. Skrobia ma budowę ziarnistą – kształt ziaren, jest uzależniony od ich pochodzenia.
Celuloza, podobnie jak skrobia, jest związkiem zbudowanym z wielu reszt glukozy (od 2500 do 10 000). Jest głównym składnikiem roślin, którym zapewnia trwałość, elastyczność i chroni przed utratą wody. Występuje w dużych ilościach w bawełnie i drewnie. Celuloza ma budowę włóknistą. Celuloza jest również nazywana błonnikiem. Człowiek nie trawi tego cukru, ale spełnia on ważną rolę w prawidłowym funkcjonowaniu układu pokarmowego.
Skrobia i celuloza to białe substancje stałe. Wielocukry te nie mają słodkiego smaku. Skrobia słabo rozpuszcza się w zimnej wodzie, w gorącej natomiast pęcznieje. Tworzy kleik skrobiowy, który jest roztworem koloidalnym, zwyczajowo nazywanym krochmalem. Obydwa cukry nie rozpuszczają się w rozpuszczalnikach organicznych.
Do wykrywania skrobi w produktach spożywczych służy próba jodoskrobiowa – reakcja skrobi z jodyną, w wyniku której powstaje ciemnogranatowe zabarwienie.
Do polisacharydów należy także glikogen. Pod względem budowy przypomina on skrobię. Jego cząsteczki mają jednak bardziej rozgałęzioną strukturę. Stanowi materiał zapasowy w organizmach ludzi i zwierząt. Gromadzi się głównie w mięśniach oraz w wątrobie. Produktem rozkładu glikogenu jest glukoza, która spala się, dostarczając organizmowi energii.
ZASTOSOWANIE POLISACHARYDÓW:
Skrobię wykorzystuje się przede wszystkim w przemyśle spożywczym, jako mąkę ziemniaczaną. Ze względu na konsystencję mieszaniny skrobi i wody służy ona m.in. do produkcji kisieli i budyniów. Stosuje się ją również do produkcji klejów, leków i kosmetyków (pudry, zasypki dla dzieci).
Celuloza również ma szerokie spektrum zastosowań, głównie w przemyśle papierniczym. Używa się jej także do produkcji lakierów, klejów, materiałów wybuchowych i jedwabiu sztucznego oraz w przemyśle farmaceutycznym.
Praca domowa dla wszystkich Uczniów
Obejrzyj film https://vod.tvp.pl/video/podroze-z-historia,jak-powstaje-papier,29860750
21.05.2020 r. /czwartek/
Temat: Podsumowanie wiadomości z działu „Substancje o znaczeniu biologicznym”
Przeczytaj wiadomości z ostatnich 3 lekcji o węglowodanach (sacharydach, cukrach).
W celu sprawdzenia swojej wiedzy zrób zadania z podręcznika str. 220.
W przyszłym tygodniu, we wtorek 26 maja 2020r. o godz. 10:00 test na quizizz z węglowodanów.
26.05.2020r. /wtorek/
Temat: Sprawdzenie wiadomości o węglowodanach.
We wtorek 26 maja 2020r. o godz. 9:30 test na quizizz z węglowodanów.
Wejdź na www.quizizz.com
Zaloguj się swoim imieniem i nazwiskiem i sprawdź swoją wiedzę.
28.05.2020r. /czwartek/
Temat: Wybitne osiągnięcia w chemii – laureaci Nagrody Nobla.
Laureaci Nagrody Nobla w dziedzinie chemii – laureaci nagrody przyznawanej corocznie osobom, które dokonały odkrycia naukowego lub wynalazku w dziedzinie chemii (jednej z pięciu, w których tę nagrodę ustanowiono), wyświadczając tym największe dobrodziejstwo ludzkości. Na początku nagradzano zwykle jedną osobę w danym roku, potem coraz częściej były to dwie lub trzy osoby.
Kryterium oceny osiągnięć kandydatów do Nagrody Nobla sformułował Alfred Nobel (1833–1896) w swoim testamencie. Fundusz nagród pochodzi z odsetek od majątku fundatora, którym zarządza Fundacja Nobla. Decyzje w sprawach wyróżnień podejmuje Królewska Szwedzka Akademia Nauk, zgodnie ze ściśle opisaną procedurą. Ceremonie wręczania nagród odbywają się od roku 1901, zawsze 10 grudnia, co jest uhonorowaniem rocznicy śmierci fundatora (10 grudnia 1896).
Obejrzyj film o jedynej kobiecie na świecie, która dwukrotnie została uhonorowana Nagrodą Nobla w dwóch różnych dziedzinach: fizyce i chemii.
„Niczego w życiu nie należy się bać,
należy to tylko zrozumieć.”
Maria Skłodowska-Curie.